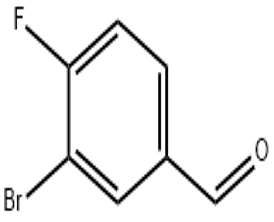
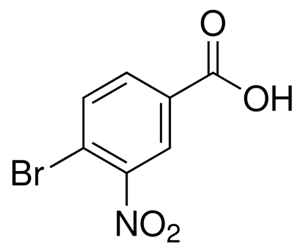
alfa-ionoon(CAS#127-41-3)
| Risiko kodes | R42/43 – Mag sensitiwiteit veroorsaak deur inaseming en velkontak. |
| Veiligheidsbeskrywing | S24/25 – Vermy kontak met vel en oë. |
| WGK Duitsland | 2 |
| RTECS | EN0525000 |
| TSCA | Ja |
| HS kode | 29142300 |
alfa-ionoon(CAS#127-41-3) inligting
Violette ketoon, ook bekend as bensofenoon, is 'n organiese verbinding. Hier is 'n paar veiligheidsinligting oor ionoon:
1. Toksisiteit: Violette ketoon het sekere toksisiteit vir die menslike liggaam. Dit kan skade aan die sentrale senuweestelsel en lewer veroorsaak, en kan nadelige uitwerking op die voortplantingstelsel en embrio's hê.
2. Gevaar vir inaseming: Inaseming van die damp of stof van ionoon kan ongemaklike simptome soos duiseligheid, lomerigheid, hoes en moeilike asemhaling veroorsaak. Langtermyn blootstelling kan skade aan die sentrale senuweestelsel veroorsaak.
3. Kontakgevaar: Violette ketoon kan deur die vel geabsorbeer word. Langtermyn of uitgebreide kontak kan vel- en oogirritasie veroorsaak. Toepaslike persoonlike beskermende toerusting soos handskoene en veiligheidsbril moet gedra word wanneer ionoon hanteer word.
4. Brandblusmaatreëls: In geval van lekkasie of brand, gebruik droë poeier, skuim of koolstofdioksied om die brand te blus. Vermy die gebruik van water, aangesien violetketoon met water reageer om vlambare gasse te produseer.
5. Afval wegdoening: Gooi afval violet ketoon behoorlik weg in ooreenstemming met plaaslike regulasies en reëls. Moenie dit in die riool of vullisdrom gooi nie.
6. Berging voorsorgmaatreëls: Violette ketoon moet gestoor word in 'n koel, droë, goed geventileerde plek, weg van bronne van vuur en oksidante.
Hierdie inligting is slegs vir verwysing. Indien verdere gebruik of verwerking van ionoon vereis word, verwys asseblief na die relevante veiligheidsdatablad en raadpleeg 'n professionele persoon.
natuur
Violette ketoon, ook bekend as linaylketoon, is 'n natuurlike ketoonverbinding. Dit is die hoofkomponent van die aroma van violetblomme.
Violette ketoon is 'n kleurlose tot liggeel olierige vloeistof wat by kamertemperatuur vlugtig is.
Violette ketoon is oplosbaar in alkohol en eter oplosmiddels, en effens oplosbaar in water. Die digtheid daarvan is relatief laag, met 'n digtheid van 0,87 g/cm³. Dit is sensitief vir lig en kan ultravioletstrale absorbeer.
Violette ketoon kan geoksideer word tot ketoon alkohole of sure in chemiese reaksies, en kan verminder word tot alkohole deur hidrogenering reduksie reaksies. Dit kan alkilerings- en veresteringsreaksies met baie verbindings ondergaan.
Toepassing en sintese metode
Violette ketoon (ook bekend as pers ketoon) is 'n aromatiese ketoonverbinding. Dit het spesiale geur en word dikwels in parfuum- en parfuumbedryf gebruik. Die volgende is 'n inleiding tot die gebruike en sintesemetodes van ionoon:
Doel:
Parfuum en speserye: die geurkenmerke van ionoon, wat wyd in die parfuum- en speserybedryf gebruik word om violetgeurprodukte te vervaardig.
Sintese metode:
Die sintese van ionoon word gewoonlik deur die volgende twee metodes bereik:
Oksidasie van Nukleobenseen: Nukleobenseen ('n benseenring met 'n metielsubstituent) word aan 'n oksidasiereaksie onderwerp, soos die gebruik van 'n oksiderende suur of 'n suur kaliumpermanganaatoplossing, om ionoon te genereer.
Koppeling van pirielbensaldehied: Pirielbensaldehied (soos bensaldehied met piridienringsubstituente in die para- of metaposisie) word met asynanhidried en ander reaktante onder alkaliese toestande gereageer om ionoon te vorm.